Atom- und Molekülstruktur
Die Bausteine der Materie sind Atome, die sich zu Molekülen oder Verbindungen verbinden. Es ist wichtig zu wissen, welche Teile eines Atoms Ionen und Isotope sind und wie Atome sich verbinden.
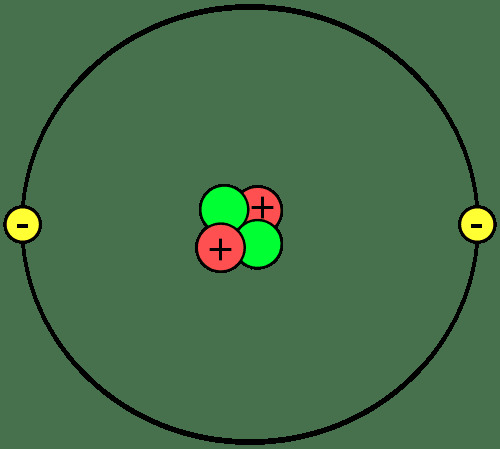
Teile eines Atoms
Atome bestehen aus drei Komponenten:
- Protonen - positive elektrische Ladung
- Neutronen - keine elektrische Ladung
- Elektronen - negative elektrische Ladung
Protonen und Neutronen bilden den Kern oder das Zentrum jedes Atoms. Elektronen umkreisen den Kern. Der Kern jedes Atoms hat also eine positive Nettoladung, während der äußere Teil des Atoms eine negative Nettoladung hat. Bei chemischen Reaktionen verlieren, gewinnen oder teilen Atome Elektronen. Der Kern nimmt nicht an gewöhnlichen chemischen Reaktionen teil, obwohl Kernzerfall und Kernreaktionen Veränderungen im Atomkern verursachen können.
Atome, Ionen und Isotope
Die Anzahl der Protonen in einem Atom bestimmt, um welches Element es sich handelt. Jedes Element hat einen Ein- oder Zwei-Buchstaben
Symbol das wird verwendet, um es in chemischen Formeln und Reaktionen zu identifizieren. Das Symbol für Helium ist Er. Ein Atom mit zwei Protonen ist ein Heliumatom, unabhängig davon, wie viele Neutronen oder Elektronen es hat. Ein Atom kann die gleiche Anzahl von Protonen, Neutronen und Elektronen haben, oder die Anzahl von Neutronen und / oder Elektronen kann von der Anzahl von Protonen abweichen.Atome, die eine positive oder negative elektrische Nettoladung tragen, sind Ionen. Wenn ein Heliumatom beispielsweise zwei Elektronen verliert, hätte es eine Nettoladung von +2, was als He geschrieben wird2+.
Durch Variieren der Anzahl der Neutronen in einem Atom wird bestimmt, welche Isotop eines Elements ist es. Atome können mit Kernsymbolen geschrieben werden, um ihr Isotop zu identifizieren, wobei die Anzahl der Nukleonen (Protonen plus Neutronen) wird oben und links von einem Elementsymbol aufgeführt, wobei die Anzahl der Protonen unten und links von der aufgeführt ist Symbol. Zum Beispiel sind drei Isotope von Wasserstoff:
11H, 21H, 31H.
Da Sie wissen, dass sich die Anzahl der Protonen für ein Atom eines Elements nie ändert, werden Isotope häufiger mit dem Elementsymbol und der Anzahl der Nukleonen geschrieben. Zum Beispiel könnten Sie H-1, H-2 und H-3 für die drei Isotope von Wasserstoff oder U-236 und U-238 für zwei gemeinsame Isotope von Uran schreiben.
Ordnungszahl und Atomgewicht
Das Ordnungszahl eines Atoms identifiziert sein Element und seine Anzahl von Protonen. Das atomares Gewicht ist die Anzahl der Protonen plus die Anzahl der Neutronen in einem Element (weil die Masse der Elektronen im Vergleich zu der von Protonen und Neutronen so klein ist, dass sie im Wesentlichen nicht zählt). Das Atomgewicht wird manchmal als Atommasse oder Atommassenzahl bezeichnet. Die Ordnungszahl von Helium beträgt 2. Das Atomgewicht von Helium beträgt 4. Beachten Sie, dass die Atommasse eines Elements im Periodensystem keine ganze Zahl ist. Zum Beispiel wird die Atommasse von Helium als 4,003 anstatt als 4 angegeben. Dies liegt daran, dass das Periodensystem die natürliche Häufigkeit von Isotopen eines Elements widerspiegelt. Bei chemischen Berechnungen verwenden Sie die im Periodensystem angegebene Atommasse, wobei angenommen wird, dass eine Probe eines Elements den natürlichen Isotopenbereich für dieses Element widerspiegelt.
Moleküle
Atome interagieren miteinander und bilden häufig chemische Bindungen miteinander. Wenn zwei oder mehr Atome miteinander verbunden sind, bilden sie ein Molekül. Ein Molekül kann einfach sein, wie z. B. H.2oder komplexer, wie C.6H.12Ö6. Die Indizes geben die Anzahl der einzelnen Atomtypen in einem Molekül an. Das erste Beispiel beschreibt ein Molekül, das aus zwei Wasserstoffatomen besteht. Das zweite Beispiel beschreibt ein Molekül, das aus 6 Kohlenstoffatomen, 12 Wasserstoffatomen und 6 Sauerstoffatomen besteht. Während Sie die Atome in beliebiger Reihenfolge schreiben können, besteht die Konvention darin, zuerst die positiv geladene Vergangenheit eines Moleküls zu schreiben, gefolgt vom negativ geladenen Teil des Moleküls. Natriumchlorid ist also NaCl und nicht ClNa.
Periodensystem Notizen und Überprüfung
Das Periodensystem ist ein wichtiges Werkzeug in der Chemie. In diesen Notizen werden das Periodensystem, seine Organisation und die Trends des Periodensystems beschrieben.
Erfindung und Organisation des Periodensystems
Im Jahr 1869, Dmitri Mendeleev organisierte die chemischen Elemente in einem Periodensystem, ähnlich dem, das wir heute verwenden, mit Ausnahme seiner Elemente wurden nach zunehmendem Atomgewicht geordnet, während der moderne Tisch durch zunehmendes Atomgewicht organisiert ist Nummer. Die Art und Weise, wie die Elemente organisiert sind, ermöglicht es, Trends in den Elementeigenschaften zu erkennen und das Verhalten von Elementen bei chemischen Reaktionen vorherzusagen.
Zeilen (von links nach rechts) werden aufgerufen Perioden. Elemente in einer Periode teilen das gleiche höchste Energieniveau für ein nicht angeregtes Elektron. Es gibt mehr Unterebenen pro Energieniveau, wenn die Atomgröße zunimmt, so dass es mehr Elemente in Perioden weiter unten in der Tabelle gibt.
Spalten (von oben nach unten) bilden die Basis für das Element Gruppen. Elemente in Gruppen teilen die gleiche Anzahl von Valenzelektronen oder die Anordnung der äußeren Elektronenhülle, wodurch Elemente in einer Gruppe mehrere gemeinsame Eigenschaften erhalten. Beispiele für Elementgruppen sind Alkalimetalle und Edelgase.
Periodensystem-Trends oder Periodizität
Die Organisation des Periodensystems ermöglicht es, Trends in den Eigenschaften von Elementen auf einen Blick zu erkennen. Die wichtigen Trends beziehen sich auf einen Atomradius, Ionisierungsenergie, Elektronegativität und Elektronenaffinität.
-
Atomradius
Der Atomradius spiegelt die Größe eines Atoms wider. Atomradius verringert die Bewegung von links nach rechts über einen Zeitraum und erhöht die Bewegung von oben nach unten eine Elementgruppe herunter. Obwohl Sie vielleicht denken, Atome würden einfach größer, wenn sie mehr Elektronen gewinnen, bleiben Elektronen in einer Hülle, während die zunehmende Anzahl von Protonen die Schalen näher an den Kern zieht. Wenn sich eine Gruppe nach unten bewegt, werden Elektronen in neuen Energieschalen weiter vom Kern entfernt gefunden, sodass die Gesamtgröße des Atoms zunimmt. -
Ionisationsenergie
Die Ionisierungsenergie ist die Energiemenge, die benötigt wird, um ein Elektron aus einem Ion oder Atom im Gaszustand zu entfernen. Ionisationsenergie erhöht die Bewegung von links nach rechts über einen Zeitraum und verringert die Bewegung von oben nach unten eine Gruppe runter. -
Elektronegativität
Die Elektronegativität ist ein Maß dafür, wie leicht ein Atom eine chemische Bindung eingeht. Je höher die Elektronegativität ist, desto höher ist die Anziehungskraft für die Bindung eines Elektrons. Elektronegativität Verringert das Abwärtsbewegen einer Elementgruppe. Elemente auf der linken Seite des Periodensystems sind in der Regel elektropositiv oder geben eher ein Elektron ab als eines zu akzeptieren. -
Elektronenaffinität
Die Elektronenaffinität gibt an, wie schnell ein Atom ein Elektron aufnehmen kann. Elektronenaffinität variiert je nach Elementgruppe. Die Edelgase haben Elektronenaffinitäten nahe Null, weil sie Elektronenschalen gefüllt haben. Die Halogene weisen hohe Elektronenaffinitäten auf, da durch Zugabe eines Elektrons ein Atom eine vollständig gefüllte Elektronenhülle erhält.
Chemische Bindungen und Bindungen

Chemische Bindungen sind leicht zu verstehen, wenn Sie die folgenden Eigenschaften von Atomen und Elektronen berücksichtigen:
- Atome suchen die stabilste Konfiguration.
- Die Oktettregel besagt, dass Atome mit 8 Elektronen in ihrem äußeren Orbital am stabilsten sind.
- Atome können Elektronen anderer Atome teilen, geben oder nehmen. Dies sind Formen chemischer Bindungen.
- Bindungen treten zwischen den Valenzelektronen der Atome auf, nicht zwischen den inneren Elektronen.
Arten von chemischen Bindungen
Die beiden Haupttypen chemischer Bindungen sind ionische und kovalente Bindungen. Sie sollten sich jedoch verschiedener Formen der Bindung bewusst sein:
-
Ionische Bindungen
Ionische Bindungen bilden sich, wenn ein Atom ein Elektron von einem anderen Atom nimmt. Beispiel: NaCl wird durch eine Ionenbindung gebildet, bei der Natrium sein Valenzelektron an Chlor abgibt. Chlor ist ein Halogen. Alle Halogene haben 7 Valenzelektronen und benötigen eine weitere, um ein stabiles Oktett zu erhalten. Natrium ist ein Alkalimetall. Alle Alkalimetalle haben 1 Valenzelektron, das sie leicht abgeben, um eine Bindung zu bilden. -
Kovalente Anleihen
Kovalente Bindungen bilden sich, wenn Atome Elektronen teilen. Der Hauptunterschied besteht darin, dass die Elektronen in Ionenbindungen enger mit einem Atom verbunden sind Kern oder der andere, dessen Elektronen in einer kovalenten Bindung ungefähr gleich wahrscheinlich einen Kern umkreisen wie der andere. Wenn das Elektron enger mit einem Atom verbunden ist als mit dem anderen, a polare kovalente Bindung kann sich bilden. Beispiel: In Wasser bilden sich kovalente Bindungen zwischen Wasserstoff und Sauerstoff, H.2Ö. -
Metallische Bindung
Wenn beide Atome Metalle sind, bildet sich eine metallische Bindung. Der Unterschied in einem Metall besteht darin, dass die Elektronen ein beliebiges Metallatom sein können, nicht nur zwei Atome in einer Verbindung. Beispiel: Metallische Bindungen sind in Proben von reinen elementaren Metallen wie Gold oder Aluminium oder Legierungen wie Messing oder Bronze zu sehen.
Sie fragen sich vielleicht, wie Sie feststellen können, ob eine Bindung ionisch oder kovalent ist. Sie können die Platzierung von Elementen im Periodensystem oder in einer Elementtabelle anzeigen Elektronegativitäten um die Art der Bindung vorherzusagen, die sich bilden wird. Wenn sich die Elektronegativitätswerte stark voneinander unterscheiden, bildet sich eine Ionenbindung. Normalerweise ist das Kation ein Metall und das Anion ein Nichtmetall. Wenn beide Elemente Metalle sind, ist mit der Bildung einer Metallbindung zu rechnen. Wenn die Elektronegativitätswerte ähnlich sind, ist mit der Bildung einer kovalenten Bindung zu rechnen. Bindungen zwischen zwei Nichtmetallen sind kovalente Bindungen. Polare kovalente Bindungen bilden sich zwischen Elementen, die zwischen den Elektronegativitätswerten mittlere Unterschiede aufweisen.
Wie man Verbindungen benennt - Chemie-Nomenklatur
Damit Chemiker und andere Wissenschaftler miteinander kommunizieren können, wurde von der Internationalen Union für reine und angewandte Chemie (IUPAC) ein System der Nomenklatur oder Benennung vereinbart. Sie hören Chemikalien, die als gebräuchliche Namen bezeichnet werden (z. B. Salz, Zucker und Backpulver), aber im Labor würden Sie systematische Namen verwenden (z. B. Natriumchlorid, Saccharose und Natriumbicarbonat). Hier finden Sie eine Übersicht über einige wichtige Punkte zur Nomenklatur.
Benennen von binären Verbindungen
Verbindungen können nur aus zwei Elementen (binären Verbindungen) oder mehr als zwei Elementen bestehen. Bei der Benennung von binären Verbindungen gelten bestimmte Regeln:
- Wenn eines der Elemente ein Metall ist, wird es zuerst benannt.
- Einige Metalle können mehr als ein positives Ion bilden. Es ist üblich, die Ladung des Ions mit römischen Ziffern anzugeben. Zum Beispiel FeCl2 ist Eisen (II) chlorid.
- Wenn das zweite Element ein Nichtmetall ist, ist der Name der Verbindung der Metallname, gefolgt von einem Stamm (Abkürzung) des Nichtmetallnamens, gefolgt von "ide". Beispielsweise wird NaCl als Natriumchlorid bezeichnet.
- Bei Verbindungen, die aus zwei Nichtmetallen bestehen, wird zuerst das elektropositivere Element genannt. Der Stamm des zweiten Elements wird benannt, gefolgt von "ide". Ein Beispiel ist HCl, das Chlorwasserstoff ist.
Ionische Verbindungen benennen
Zusätzlich zu den Regeln für die Benennung von binären Verbindungen gibt es zusätzliche Benennungskonventionen für ionische Verbindungen:
- Einige mehratomige Anionen enthalten Sauerstoff. Wenn ein Element zwei Oxyanionen bildet, endet das mit weniger Sauerstoff in -ite, während das mit mehr Oxgyen in -ate endet. Zum Beispiel:
NEIN2- ist Nitrit
NEIN3- ist Nitrat